显微荧光成像技术:原理、进展与应用
显微荧光成像技术是现代生物医学研究和临床诊断中不可或缺的工具,它通过荧光标记实现对生物样本的高灵敏度、高特异性可视化。本文将系统介绍显微荧光成像的基本原理,重点分析近年来该领域的技术突破,包括AI驱动的无滤波成像、光片荧光显微术、三光子激发成像等前沿技术,并探讨其在病理诊断、神经科学和临床手术等领域的实际应用案例。文章还将通过五幅代表性图片直观展示这些技术的成像效果和创新特点。
显微荧光成像技术概述
荧光显微成像技术是利用特定波长的光激发荧光物质(如荧光染料、荧光蛋白或量子点)发射荧光,从而实现对生物样本高对比度成像的方法。与传统光学显微镜相比,荧光显微镜具有**分子特异性强**和**灵敏度高**的特点,能够针对性地标记并观察细胞内的特定结构或分子,已成为现代生命科学研究和医学诊断的核心工具之一。
荧光成像的基本原理遵循斯托克斯位移(Stokes shift)现象:当荧光分子吸收高能量短波长光子后,电子跃迁到激发态;随后通过非辐射弛豫损失部分能量,最终以较低能量(较长波长)的光子形式发射荧光。这一特性使得荧光信号能够通过光学滤波器与激发光分离,从而获得高信噪比的图像。典型的荧光显微镜系统包括激发光源(如LED、激光)、荧光滤光片组(激发滤光片、二向色镜和发射滤光片)、物镜和探测器(如CCD或CMOS相机)等组件。
根据成像方式的不同,荧光显微技术可分为宽场荧光显微镜、共聚焦显微镜、双光子显微镜以及近年来快速发展的光片荧光显微镜(Light-sheet fluorescence microscopy, LSFM)等。其中,宽场荧光显微镜结构简单、成像速度快,但存在离焦背景干扰;共聚焦显微镜通过针孔消除离焦光,提高了轴向分辨率,但光子利用率较低;双光子显微镜利用近红外激光激发,穿透深度大,适合厚组织成像;而光片显微镜则通过薄片状照明显著降低了光毒性和光漂白效应,特别适合活体样本的长时间三维成像。
*表:主要荧光显微成像技术比较
| 技术类型 | 分辨率 | 成像深度 | 光毒性 | 成像速度 | 主要应用 |
| 宽场荧光显微镜 | 横向200-300nm | 较浅 | 中等 | 快 | 细胞培养观察、快速动态过程 |
| 共聚焦显微镜 | 横向180-250nm 轴向500-800nm | 中等(~100μm) | 较高 | 中等 | 高分辨率三维成像、共定位分析 |
| 双光子显微镜 | 横向300-500nm 轴向1-2μm | 深(可达1mm) | 低 | 较慢 | 活体组织成像、神经活动监测 |
| 光片显微镜 | 横向200-400nm 轴向1-3μm | 中等至深(视样本透明度) | 极低 | 快 | 大体积样本三维成像、长期活体观察 |
随着荧光探针技术、光学工程和计算方法的进步,现代荧光显微成像正朝着**更高分辨率**、**更快速度**、**更深穿透**和**更智能化**的方向发展,不断拓展其在生物医学领域的应用边界。
技术创新:AI与新型成像方法
近年来,人工智能技术的引入为荧光显微成像带来了**革命性突破**。上海理工大学庄松林院士和张大伟教授团队开发的"无滤波荧光显微成像技术"彻底改变了传统荧光显微镜必须依赖物理滤光片组的设计理念。该团队利用AI算法构建"数字虚拟滤波器",通过暗场照明降低背景噪声,再由神经网络自动选择荧光通道并预测荧光信号,实现了无需昂贵滤光元件的荧光成像系统。这一创新不仅简化了显微镜结构,还将肿瘤病理检测时间从20分钟缩短至仅4分钟,效率提升5倍之多,为临床快速诊断提供了全新解决方案。
在算法层面,复旦大学颜波团队开发的**UniFMIR模型**代表了荧光图像增强技术的最新进展。这一跨任务、多维度的基础AI模型采用Swin Transformer结构,通过大规模预训练和任务微调,在超分辨率重构、各向同性重构、3D去噪等五大任务上均表现出色,为不同成像模式和生物结构提供了通用的图像增强解决方案。该模型的成功验证了AI在突破光学硬件和生物样本光敏感性限制方面的巨大潜力。
光片荧光显微镜(LSFM)作为三维成像的重要工具,近期也取得了显著进展。一种紧凑型多色LSFM系统体积仅为30cm×30cm×40cm,通过均值漂移超分辨算法将分辨率从530nm提升至330nm,实现了对活体样本的长时间超分辨三维成像。针对大视场成像中的空间不均匀退化问题,研究人员开发了位置相关的模型驱动反卷积网络,通过分块对应重建方法显著提高了大视场图像的处理效率和质量均匀性。此外,无衍射光片技术通过双环调控方法解决了贝塞尔光片旁瓣过重的问题,产生的光片厚度可在0.4-5μm间调节,旁瓣占比低于30%,实现了从微米到厘米级样本的多尺度三维成像。
在深层组织成像方面,三光子激发荧光(3PEF)显微镜突破了传统双光子成像在**脊髓研究**中的局限。得益于三光子激发的更长波长和更高非线性特性,3PEF可在活体小鼠脊髓中实现深度达550μm的多色成像,清晰展示血管网络中的血流动态、神经突结构变化以及小胶质细胞与血管的相互作用。这一技术为研究脊髓损伤和神经退行性疾病提供了前所未有的观察窗口。
超分辨荧光成像技术也持续发展,浙江大学钱骏团队将聚集诱导发光(AIE)荧光探针应用于STED显微镜,显著降低了光漂白效应(<10%),提高了受激发射损耗效率。与传统STED探针Coumarin 102相比,AIE探针在相同条件下展现出更优的成像性能,为长期超分辨观察开辟了新途径。
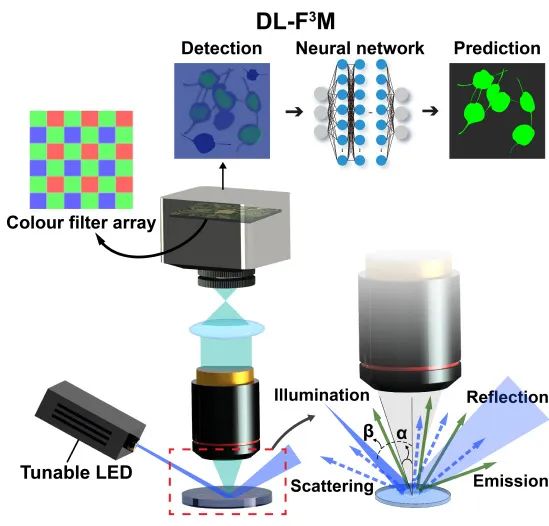
*图1:AI驱动的荧光显微成像原理示意图(改编自MEMS)*
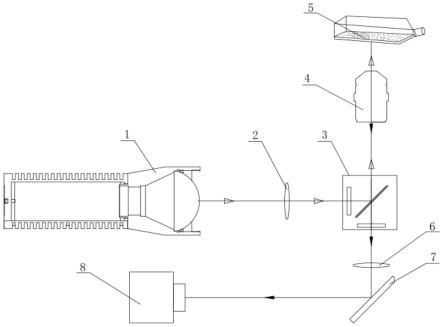
*图2:紧凑型光片荧光显微镜系统结构及其对鼠肠切片的三维成像效果(源自国知局)*
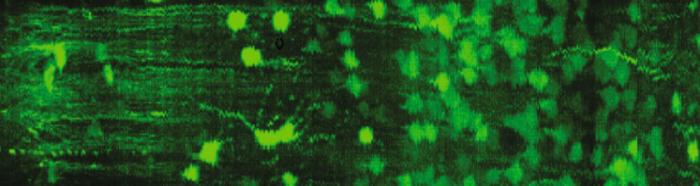
*图3:三光子显微镜对活体小鼠脊髓550μm深处的多色成像(改编自新浪网)*
这些技术创新不仅解决了传统荧光成像中的关键瓶颈问题,还通过多学科交叉融合不断拓展技术的应用边界,为生命科学研究和医学诊断提供更加强大的工具。
应用领域与典型案例
显微荧光成像技术的快速发展使其在生物医学领域的**应用范围**不断扩展,从基础研究到临床诊断均发挥着重要作用。在病理学领域,传统二维切片分析正在向三维病理转变,光片荧光显微镜能够提供组织结构的完整空间信息,有助于更全面地理解疾病发生机制。上海理工团队开发的无滤波荧光成像系统已成功应用于成纤维细胞活化蛋白表达分析、人食管组织和肝组织切片检测,其高效率特点特别适合临床病理的快速筛查。
在神经科学研究中,荧光成像技术为解析**神经系统**的复杂结构和功能提供了关键工具。一项针对猪耳蜗螺旋神经节神经元(SGNs)的研究结合组织透明化和光片显微技术,开发了基于深度学习的Spiner分析系统,能够自动定位和计数大体积3D数据集中的SGNs。三光子显微镜则实现了对活体小鼠脊髓灰质深处(达550μm)的成像,可清晰观察不同血管类型的血流动态、神经突的深度依赖性结构变化以及小胶质细胞与血管的相互作用,为脊髓损伤和神经退行性疾病研究提供了新视角。
临床手术导航是荧光成像的另一重要应用场景。济南显微智能科技有限公司开发的**荧光分子成像系统**已达到皮摩尔级超高灵敏度,广泛应用于前哨淋巴结活检、肿瘤成像、甲状旁腺定位等外科场景。其甲状旁腺荧光摄像系统获得国家二类医疗器械注册证,成为全球少数掌握自体荧光成像商业化技术的企业之一。这类术中荧光导航系统显著提高了手术精准度,减少了并发症风险。
在环境监测和刑侦领域,荧光成像技术也展现出独特价值。上海理工团队指出,其无滤波荧光成像技术可应用于刑侦勘探,快速分析犯罪现场获取的微量生物样本。荧光寿命成像(FLIM)则被用于潜指纹检测,通过荧光寿命差异增强指纹与背景的对比度。此外,微区荧光光谱技术结合STED超分辨显微镜,可对有机材料进行纳米级表征,在材料科学领域具有应用潜力。
基础生物学研究同样受益于先进的荧光成像技术。光片显微镜因其低光毒性和高成像速度,特别适合胚胎发育过程的长时间观察。多色荧光成像可以同时标记多种细胞或分子组分,研究它们之间的空间关系和相互作用动态。复旦大学开发的UniFMIR模型则通过统一的AI框架提升了各类荧光图像的质量,使研究人员能够从噪声大、分辨率低的原始数据中提取更多生物学信息。
这些应用案例充分展示了荧光显微成像技术的**多面性价值**,从微观的分子相互作用到宏观的器官功能研究,从基础科学探索到临床诊疗实践,该技术正在不断改写生物医学研究的可能性边界。随着技术的进一步发展和普及,预计将有更多创新应用场景被开发出来。
技术挑战与未来展望
尽管显微荧光成像技术已取得显著进展,但仍面临若干**关键挑战**。在硬件层面,深层组织成像中的散射问题尚未完全解决,即使三光子显微镜在脊髓成像中可达550μm深度,但对于更大体积或不透明样本仍存在局限。光片显微镜虽降低了光毒性,但在处理高度散射或异质性强的生物组织时,成像质量和分辨率仍会下降。此外,超分辨技术如STED显微镜依赖特殊荧光探针,探针的光稳定性和生物相容性仍需进一步优化。
计算方法是另一挑战领域。虽然AI大幅提升了图像质量和分析效率,但模型的泛化能力受训练数据质量和多样性的限制。例如,统一荧光显微镜图像增强模型UniFMIR需要针对不同任务微调参数,而完全自主适应不同成像条件和样本类型的通用算法仍有待开发。三维大数据集的处理也是瓶颈之一,如猪耳蜗的3D荧光数据集达26.53GB,对存储和计算资源提出很高要求。
未来发展方向可能集中在以下几个**创新领域**:首先,"**虚拟显微镜**"概念将进一步发展,通过结合AI算法与简化光学硬件,如数字虚拟滤波器或计算光学元件,实现更紧凑、智能化的成像系统。其次,多模态融合成像将成为趋势,例如结合荧光寿命(FLIM)、光谱信息和超分辨技术,提供更丰富的样本多维数据。第三,自适应光学与深度学习结合有望解决深层组织成像中的像差和散射问题,拓展成像深度极限。
在应用层面,随着**精准医疗**需求增长,荧光成像技术将更深入地融入临床流程。术中实时荧光导航系统如显微智能的产品将更加普及和智能化,可能整合增强现实(AR)技术提供更直观的手术引导。在药物研发领域,高内涵筛选结合三维荧光成像将提高化合物评价效率。此外,便携式和低成本荧光成像设备的开发将使技术惠及更多资源有限地区。
标准化和自动化是另一重要趋势。当前各实验室自主研发的系统如定制光片显微镜存在方法差异,不利于数据比较和共享。未来需要建立统一的**质量标准**和数据处理流程,特别是对于AI模型训练所需的标注数据集。自动化样本制备、图像采集和分析的全流程整合也将提高研究可重复性和通量。
*表:显微荧光成像未来发展的关键方向*
| 发展方向 | 技术特征 | 预期影响 | 主要挑战 |
| 硬件智能化 | AI驱动、简化光学结构、自适应调节 | 降低成本、提高易用性、扩大应用场景 | 算法可靠性、系统稳定性 |
| 多模态融合 | 结合荧光强度、寿命、光谱、偏振等信息 | 提供更全面的样本表征 | 数据整合难度、系统复杂性 |
| 深层成像突破 | 新型激发方式(如三光子)、自适应光学、组织透明化 | 实现器官甚至整体小动物的细胞级成像 | 光毒性控制、数据处理量 |
| 临床转化加速 | 便携化、标准化、与治疗设备集成 | 推动精准医疗、个性化治疗 | 法规审批、医疗习惯改变 |
| 自动化分析 | AI辅助从图像到生物学发现的端到端流程 | 提高研究效率、发现新现象 | 模型可解释性、数据偏见 |
未来五到十年,随着光学工程、探针化学、计算方法和人工智能的协同进步,显微荧光成像技术将继续突破现有极限,为生命科学发现和医疗健康创新提供更强大的可视化工具。跨学科合作将是这一进程的关键,需要物理学家、工程师、计算机科学家和生物医学研究者的紧密协作,共同推动这一领域向前发展。